河北MDCK宿主細胞殘留DNA檢測常用知識
來源:
發布時間:2025-08-12
湖州申科生物針對宿主細胞殘留 DNA 檢測,構建了完善開發流程。先通過生物信息學分析設計引物探針,篩選合理靶標序列、設計高效引物探針 。接著確認體系(PCR - 熒光探針法 ),標準曲線設至少 5 個濃度點,擴增效率需達 83.3% - 110%、R2≥0.980,保證專屬性與合適定量限 。然后開展方法驗證,滿足《中國藥典》四部 9101、ICH Q2 (R2) 等指導原則及申報要求 。再進行樣品檢測,遵循《中國藥典》三部 3407、USP <509> 標準,設置充分中間質控樣品,多環節把控確保檢測科學、規范、可靠,為宿主細胞殘留 DNA 檢測提供有效技術方案 。
湖州申科生物一站式宿主細胞殘留核酸檢測平臺已完成各類型產品檢測驗證。河北MDCK宿主細胞殘留DNA檢測常用知識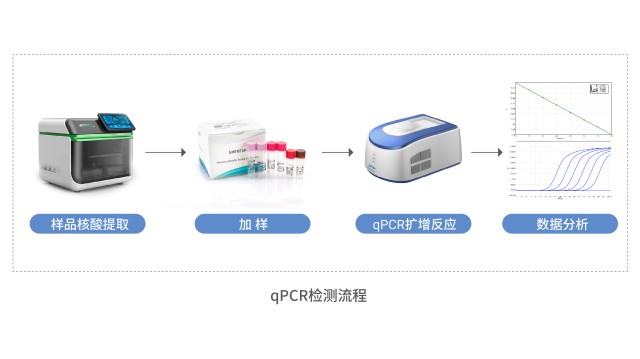
在宿主細胞殘留 DNA 檢測中,若出現擴增效率不合格情況,可按以下思路排查。先做數據分析,查看標曲線性圖是否為正常 “S” 型擴增曲線,整體熒光信號是否偏低、復孔間信號有無交錯,信號選擇是否正常,有無離群點,程序設置是否正確 。接著進行耗材 / 設備排查,檢查 EP 管等是否為無菌低吸附,移液器、PCR 設備是否在校驗期,PCR 設備與 PCR 耗材是否匹配 。然后開展人員 / 試劑排查,確認是否只有某一操作員標曲異常,試劑儲存有無誤,是否從某一時間點起結果異常 。以上摸排后再進行操作排查,關注標曲稀釋是否渦旋混勻及時間是否合適,取液時是否預潤洗,移液速度,MIX 混勻及力度,上機前離心混勻情況,數據分析時基線、閾值線是否合適,ROX 矯正等操作細節 。
河北MDCK宿主細胞殘留DNA檢測常用知識生物制品宿主細胞殘留 DNA 可能存在污染風險,將對產品使用者帶來??潛在安全性影響。
SHENTEK®畢赤酵母殘留 DNA 檢測試劑盒用于定量檢測各種生物制品及藥品的中間品、半成品和成品中畢赤酵母宿主細胞 DNA 的試劑盒。試劑盒利用熒光探針原理,定量檢測樣品中畢赤酵母殘留 DNA。檢測快速,專一性強,性能穩定可靠,檢測限可以達到 fg 級別。試劑盒配套有畢赤酵母 DNA 定量參考品。本試劑盒與 SHENTEK® 宿主細胞殘留 DNA 樣本前處理試劑盒配套使用,整個分析系統通過優化前處理與檢測步驟的兼容性,提升了對畢赤酵母細胞微量 DNA 殘留的回收率與定量準確度。
宿主細胞殘留 DNA 檢測的方法驗證包含三類。完整驗證針對新分析方法、文獻報道方法及研發商業試劑盒;部分驗證用于已完整驗證的生物分析方法的修改場景,像方法轉移(如實驗室轉移 )、檢測方法改變(如換儀器 )、樣品基質變化、同一基質不同種屬變化(rat - mouse )、相關線性濃度范圍變化、前處理方法改變等情況;交叉驗證則在應用不同方法從一項或多項試驗獲數據,或同一方法從不同試驗地點獲數據,需對比這些數據時開展,通過不同驗證類型適配多樣檢測需求,保障檢測方法可靠有效 。
SHENTEK? 系列宿主細胞殘留DNA檢測試劑盒凍融 5 次,性能不受影響。
在宿主細胞殘留 DNA(HCD)檢測試劑盒更換時,需進行系列驗證考量。首先參考《已上市生物制品藥學變更研究技術指導原則(試行)》,依對生物制品安全性、有效性和質量可控性的風險及影響程度分類,實施變更要開展充分研究與驗證 。接著做全面性能驗證,用藥典或經驗證檢測方法,證明變更后分析方法等效或更優 。然后進行樣品檢驗,對比變更前后產品質量數據并綜合評估,借穩定性研究開展穩定性可比性分析,檢測細微差異,評價變更對產品質量影響 。以上完成后再進行更換試劑盒備案,若變更后方法同原方法或更優,據待檢樣品是原液或制劑,分屬中等或微小變更,微小變更可在中等變更申請時一并說明 。
SHENTEK? 系列宿主細胞殘留DNA檢測試劑盒適配SHENTEK-96S等常用PCR設備。重慶Human宿主細胞殘留DNA檢測銷售廠家針對宿主細胞殘留DNA檢測,湖州申科生物還提供技術服務,包括HCD特定開發、方法學驗證等。河北MDCK宿主細胞殘留DNA檢測常用知識
關于宿主細胞殘留DNA(rDNA)的風險研究,主要包括傳染性、致病性、免疫原性等,各國藥典對其殘留量有著嚴格的限度要求:美國食品藥品監督管理局(FDA)發布的指導原則中指出生物制品宿主細胞DNA殘留限度不得超過100 pg/劑,對于大劑量的生物制品(如單克隆抗體),根據其殘留DNA來源及給藥途徑,DNA殘留量可放寬至10 ng/劑。《歐洲藥典》通則規定的生物制品殘留DNA限度大多為不超過10 ng/劑。2025版《中國藥典》三部規定,以細胞基質生產的生物制劑DNA殘留量不能超過100 pg/劑。
河北MDCK宿主細胞殘留DNA檢測常用知識
相關新聞
- 廣東MDCK宿主細胞蛋白(HCP)殘留檢測 2025-08-19
- 浙江E.coli表達菌宿主細胞蛋白(HCP)殘留檢測供應廠家 2025-08-19
- 江蘇單抗藥物用宿主細胞蛋白(HCP)殘留檢測方法開發 2025-08-18
- 成都生物制品宿主細胞蛋白(HCP)殘留檢測試劑盒開發要求 2025-08-18
- 浙江ELISA法宿主細胞蛋白(HCP)殘留檢測抗體覆蓋率驗證 2025-08-18
- 釀酒酵母宿主細胞蛋白(HCP)殘留檢測橋接驗證 2025-08-18
- 江蘇工藝特異型宿主細胞蛋白(HCP)殘留檢測常見問題分析 2025-08-18
- 上海單抗藥物用宿主細胞蛋白(HCP)殘留檢測 2025-08-18
- 上海生物制品宿主細胞蛋白(HCP)殘留檢測高風險蛋白 2025-08-18
- 北京BHK宿主細胞蛋白(HCP)殘留檢測常見問題分析 2025-08-18
推薦新聞
- 龍華區標準生物試劑收費 2025-08-19
- 重慶智慧農業葉綠素熒光成像系統 2025-08-19
- 臺州仿生手假肢公司 2025-08-19
- 靜安區本地內窺鏡工廠直銷 2025-08-19
- 美容院美容儀器多少錢 2025-08-19
- 北京健康高韌性尼龍 2025-08-19
- 天津醫用創口貼生產企業 2025-08-19
- 松江區顯微鏡多少錢 2025-08-19
- 崇明區環境監測儀器 2025-08-19
- 工業園區健康高韌性尼龍 2025-08-19